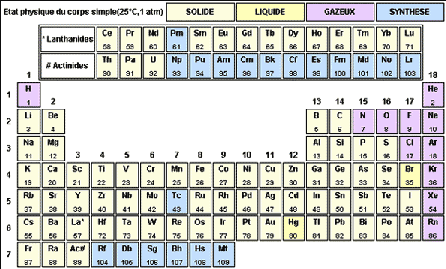
 Tableau périodique des éléments de Mendeleiev
Tableau périodique des éléments de Mendeleiev
Depuis l’antiquité l’homme a tenté de trouver une explication simple à la complexité de la matière qui l’entoure. On a d’abord pensé que les éléménts de toute matière se résumaient à l’eau, la terre, le feu et l’air.
Cette théorie fut délaissée progressivement à mesure que les techniques expérimentales de plus en plus perfectionnées pour étudier la matière et les phénomènes de l’univers physique ont été développées.
C’est au chimiste russe : Dimitri Ivanovitch Mendeleiev (1834 - 1907) que revient le mérite d’avoir structuré une classification cohérente de l’ensemble des éléments.
Le tableau périodique reste, après un siècle, le plus important moyen de comparaison entre les éléments chimiques. Il nous permet d’étudier rationnellement la grande variété des substances que nous trouvons dans la nature.
Cet article a été rédigé à partir du lien suivant :
– http://mendeleiev.cyberscol.qc.ca/carrefour/historique.html
– http://fr.wikipedia.org/wiki/Tableau_p%C3%A9riodique_des_%C3%A9
I- LES REGIONS DU TABLEAU PERIODIQUE
Le tableau périodique se divise en trois grandes régions possédant des propriétés communes :
– les métaux
– les non-métaux
– les métalloides
1- Les métaux
Les métaux sont les plus nombreux du tableau périodique. On retrouve ces éléments à gauche d’une diagonale allant du Bore (B) à l’Astate (At). Tous les métaux, sauf le mercure (Hg), sont solides à la température de la pièce. Ils sont luisants, malléables, ductiles, ils conduisent l’électricité et la chaleur et plusieurs d’entre eux réagissent avec des acides.
2- Les non-métaux
Les non-métaux se trouvent dans la partie droite du tableau. Ils ont des aspects très variés et ils possèdent des propriétés très différentes de celles des métaux. Ils sont ternes, ne conduisent pas ni l’électricité ni la chaleur. Ils ne peuvent être laminés et ne sont pas ductiles.
3- Les métalloides (signifiant "semblables aux métaux")
Les métalloides se situent le long de la frontière en forme d’escalier séparant les deux groupes précédents. Ces éléments ressemblent aux non-métaux mais conduisent, à divers degrés, le courant électrique comme les métaux.
D’une façon un peu plus détaillée on distingue 6 régions :
– les métaux : à gauche
– les non-métaux : à droite
– les semis-métaux : entre les deux précédents
– les métaux de transition (colonnes 3 à 12)
– les lanthanides : Z = 57 à 71
– les actinides : Z = 89 à 103
Rq : Z est le numéro atomique : nombre de protons.
II- LES RANGEES HORIZONTALES DU TABLEAU PERIODIQUE : 1 à 7 = NOMBRE DE COUCHES ELECTRONIQUES
Les rangées horizontales forment les périodes.
Les électrons des éléments occupant une même période sont distribués sur un même nombre de couches éléctroniques, nombre donné par le numéro de période.
III- LES RANGEES VERTICALES DU TABLEAU PERIODIQUE : 1 à 18 = NOMBRE D’ELECTRONS DE VALENCE
Les colonnes verticales forment les familles. Les éléments appartenant à une même famille ont en commun certaines caractéristiques. L’explication de ce comportement repose sur le fait que le nombre d’électrons de leur couche la plus périphérique est identique.
Exemple : Li et Na ont un seul électron qui circule sur la couche la plus externe. Or c’est cet électron externe qui sera disponible pour des réactions chimiques avec d’autres atomes. D’où des propriétés chimiques proches.
Certains éléments d’une même colonne ont reçu des noms.
Voici 7 colonnes particulières :
– colonne 1 : les Métaux Alcalins
– colonne 2 : les Métaux Alcalino-Terreux
– colonne 14 : les Cristallogènes
– colonne 15 : les Pnictogènes
– colonne 16 : les Chalcogènes
– colonne 17 : les Halogènes
– colonne 18 : les Gaz nobles (ou gaz inertes ou gaz rares)
L’Hydrogène n’appartient à aucune famille chimique.
1- Les Métaux Alcalins
Les Alcalins se situent à l’extrême gauche du tableau. Tous les éléments de cette famille chimique ont en commun une très grande réactivité aux non-métaux et à l’eau. En réagissant avec cette dernière : ils font un "alcali". ce sont des métaux mous, légers et d’aspect argenté. Ils n’existent pas à l’état pur dans la nature ; ils sont toujours combinés à d’autres éléments.
2- Les Métaux Alcalino-Terreux
Ils présentent en solution des propriétés alcalines et se retrouvent dans plusieurs roches. Ce sont des solides gris métalliques. Ils ont des analogies avec les alcalins mais sont plus durs et moins réactifs.
3- Les Halogènes
Ils sont tellement réactifs qu’on ne les rencontre qu’à l’état combiné dans la nature. Ils forment des "sels" avec les Alcalins et des acides forts avec l’hydrogène.
4- Les Gaz Nobles
Tous ces éléments ont une réactivité chimique presque nulle aux autres éléments. Ils se caractérisent par une très grande stabilité chimique grâce à leurs couches électroniques saturées. Incolores à l’état naturel : ils émettent des couleurs caractéristiques dans des tubes à vide.
IV- PRINCIPALES CARACTERISTIQUES DU TABLEAU PERIODIQUE
– Pour les éléments d’une même famille : plus le numéro atomique Z augmente : plus le rayon de l’atome augmente.
– Pour les éléments d’une même famille : plus le numéro atomique Z augmente : plus l’énergie d’ionisation diminue.
– Pour les éléments d’une même période : plus le numéro atomique Z augmente : plus les propriétés métalliques diminuent.
– Pour les éléments d’une même période : plus le numéro atomique Z augmente : plus le rayon de l’atome tend à diminuer.
– Pour les éléments d’une même période : plus le numéro atomique augmente : plus l’énergie d’ionisation augmente.
Vous trouverez en document joint le tableau périodique des éléments sous format excel.
 Yrelay.com
La planète de la communauté !
Yrelay.com
La planète de la communauté !