 Diagramme de phase : généralités
Diagramme de phase : généralités
Un diagramme de phase est une expression utilisée en thermodynamique ; elle indique une représentation graphique, généralement à deux ou trois dimensions, représentant les domaines de l’état physique ou phase d’un système (corps pur ou mélange de corps purs), en fonction de variables, choisies pour faciliter la compréhension des phénomènes étudiés.
Les diagrammes les plus simples concernent un corps pur avec pour variables la température et la pression.
Le diagramme de phase s’établit expérimentalement : on fait varier les conditions et l’on observe les changements de phase.
Les changements de phase peuvent s’observer de plusieurs manières :
– certains produisent de la chaleur (par exemple la condensation ou une réaction chimique exothermique) ou en absorbent (par exemple la fusion ou des réactions chimiques endothermiques), donc en mesurant les flux de chaleur, on sait si un changement de phase a lieu ; c’est l’analyse thermodifférentielle (ATD) ;
– certains induisent un changement de volume, une contraction (comme la condensation ou le réarrangement des atomes d’un solide dans une configuration plus compacte) ou une expansion (comme la vaporisation ou le réarrangement des atomes d’un solide dans une configuration moins compacte), il suffit alors de mesurer les changements de volume, par exemple avec un piston mobile, la force étant imposée par le poids d’une masse ou bien par un système hydraulique ;
– on peut à l’inverse observer les variations de pression, avec un manomètre, en imposant le volume avec un piston mobile actionné par une vis sans fin ;
– observer à l’œil nu l’état du système (par exemple la fusion des cristaux) ;
– pour les différentes phases solides, on peut reconnaître les différentes phases cristallines par diffraction de rayons X ; on peut faire l’analyse sur l’échantillon chaud, ou bien tremper l’échantillon, c’est-à-dire lui faire subir un refroidissement rapide afin qu’il conserve sa structure d’équilibre à chaud même lorsqu’il est froid (il n’est donc pas à l’équilibre).
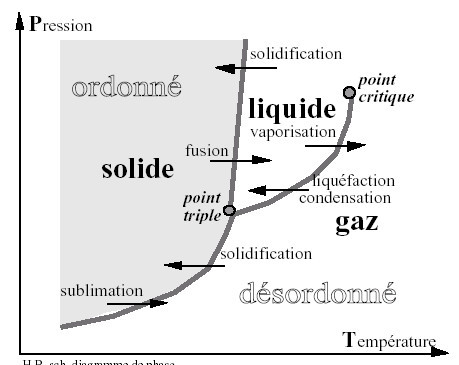
1- Diagramme de phase d’un corps pur
En fonction des conditions de pression et température, un corps pur se présente sous une ou plusieurs de ses phases : solide, liquide, gazeuse.
Pour une pression et une température données, un corps existe généralement sous une seule phase sauf :
– au point triple où les 3 phases coexistent à une température et à une pression données,
– pour un couple (pression, température) correspondant à une transition de phase.
Définition du point critique :
Entre une phase liquide et une phase vapeur (vaporisation - liquéfaction) : la courbe de changement d’état s’interrompt en un point appelé point critique, au-delà 3 duquel le corps ne présente plus qu’une seule phase : "fluide", plutôt proche d’un gaz aux pressions inférieures à la pression critique, plutôt proche d’un liquide aux températures inférieures à la température critique.
2- Diagramme Binaire
Lorsque l’on a un système composé de deux corps purs, le système peut être sous plusieurs formes :
– entièrement solide, chaque corps cristallisant séparément ;
– entièrement solide, les deux corps étant parfaitement mélangés sous la forme d’un composé défini, appelé "eutectique", "eutectoïde", "péritectique" ou "péritectoïde" selon la manière dont il se décompose en chauffant ;
– mélange solide-liquide ;
– entièrement liquide, sous la forme de deux liquide non miscibles (émulsion), ou d’un seul liquide parfaitement homogène (une seule phase) ;
– mélange liquide-gaz (aérosol, ou bien gaz au-dessus d’un liquide) ;
gaz (un gaz est toujours homogène pour de faibles variations d’altitude).
Commençons par un exemple de diagramme binaire simple à solution solide unique :
Dans certains cas, comme par exemple pour les alliages argent-or, il n’y a pas de composé défini. Dans ces cas-là, le diagramme binaire est très simple, comme illustré ci-dessous :
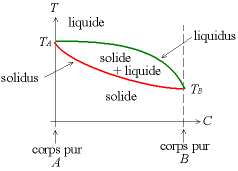
– TA la température de fusion du corps pur A,
– TB la température de fusion du corps pur B,
– Liquidus : au-dessus de cette courbe, le produit est entièrement liquide,
– Solidus : en dessous de cette courbe, tout le produit est solide
Entre le liquidus et le solidus, on a un mélange solide-liquide.
La solidification se fait en général par précipitation : il y a formation de germes de phase solide au sein du liquide (germination, nucleation en Anglais) puis croissance de ces germes.

À pression constante, la solidification des corps purs se fait à température constante , la chaleur libérée par la solidification (chaleur latente de fusion) compense la chaleur perdue par le refroidissement.
Voici maintenant un exemple d’un diagramme binaire où coexistent plusieurs phases :

3- Les composés définis
Les composés définis sont des composés dont le changement de phase se fait à température constante. On distingue :
– les eutectiques : un eutectique fond à température constante, il se comporte en fait comme un corps pur ;
– les eutectoïdes : les eutectoïdes subissent une transformation de phase solide-solide à température constante ; la seule différence avec les eutectiques est que la phase au-delà de la température limite n’est pas liquide ;
– les péritectiques : il y a une transformation solide A → solide B + liquide à température constante ;
– les péritectoïdes : il y a une transformation solide A → solide B + solide C à température constante.
Cet article a été rédigé à partir des liens :
– http://fr.wikipedia.org/wiki/Diagramme_de_phase
– http://heberge.univ-tlemcen.dz/ b_belhachemi/diagrammes.html
– http://www.techno-science.net/?onglet=glossaire&definition=3335
– http://www.unice.fr/zetetique/polycop_phys.pdf
 Yrelay.com
La planète de la communauté !
Yrelay.com
La planète de la communauté !